玻璃腐(非金属材料)普遍性腐蚀及选择性腐蚀
玻璃与水接触时,可以发生溶解和化学反应。这些化学反应包括水解及在酸、碱、盐水溶液中的腐蚀,除开这种普遍性的腐蚀外,还有由于相分离所导致的选择性腐蚀。在下面,将分别讨论这些非金属材料的腐蚀问题。
溶解
SiO2是玻璃最主要的组元,图6-12示出pH值对可溶SiO2的影响:当pH<8,SiO2在水溶液中的溶解量很小;而当pH>9以后,溶解量则迅速增大。这种效应可从图6-13所示的模型得到说明:
(1)在酸性溶液中,要破坏所形成的酸性硅烷桥困难,因而溶解少而慢;
(2)在碱性溶液中,Si—OH的形成容易,故溶解度大。
水解及腐蚀
含有碱金属或碱土金属离子R(Na+,Ca2-等)的硅酸盐玻璃与水溶液接触时,不是“溶解”,而发生了“水解”,这时,所要破坏的是Si—O—R,而不是Si—O—Si。
水解时,R形成水溶性盐进人溶液,而R为H置换,使Si—O—R转化为Si—O—H,这种新形成的Si—O—H与原有的Si—O—Si形成胶状物,可阻止腐蚀继续进行,受H+向内扩散的控制。
因此,在酸性溶液中,即pH<7时,R+为H+所置换,但Si—O—Si骨架未动,所形成的胶状产物又能阻止反应继续进行,故腐蚀少。
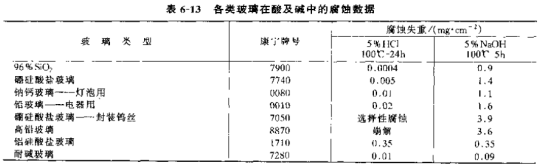
但是,在碱性溶液中则不然,如图6-13所示,OH—破坏了Si—O—Si链,而形成Si-OH及—Si—O—Na,因此腐蚀较水或酸性溶液为重,并不受扩散控制。表6-13中的腐蚀数据证实了上述的分析,其中“耐碱玻璃”由于含有ZrO2,故在碱中
的腐蚀速度也很低。
般说来,含有足够量SiO2的硅酸盐玻璃是耐酸蚀的。但是,为了获得某些光学性能的光学玻璃中,降低了SiO2,加入了大量Ba、Pb及其他重金属的氧化物,正是由于这些氧化物的溶解,使这类玻璃易为醋酸、硼酸、磷酸等弱酸腐蚀,此外,由于阴离子F的作用,氟氢酸极易破坏Si—O—Si键而腐蚀玻璃:
与-般的化学反应相似,升温也增加玻璃的腐蚀速度(图6-14)。 图6-15指出pH>8时硼硅酸盐玻璃的腐蚀失重随pH值的升高而增加。
选择性腐蚀
如图6-16所示的SiO2 - B2O3-Na20三元系中的“影线区”的成分,通过热处理(例如580C,3~168h),可以形成双相组织-孤立的硼酸盐相弥散在高SiO2基体之中。这种双相组织的玻璃在酸中发生了选择性腐蚀,富B2O3的硼酸盐相受蚀,而高SiO2的基体没有变化,从而形成疏松的玻璃。孔洞的直径在3~6nm之间,孔洞的体积可达28%。再通过弱碱性处理,由于溶去孔洞内部的高SiO2的残存区,可扩大孔洞直径。
其他不少玻璃也具有这种相分离及选择性腐蚀的性能。例如,简单的钠玻璃也可通过上述的热处理-腐蚀工艺,获得孔洞直径为0.7nm的疏松玻璃,显示分子筛的功能。
转载请注明精川材料检测地址:www.jctest.vip




